Adaptacyjna serwowentylacja (ASV) jest nieinwazyjną terapią wentylacyjną, która zapewnia zmienne wdechowe dodatnie ciśnienie w drogach oddechowych (IPAP) w celu wspomagania wdechu, gdy amplituda oddechów jest zmniejszona, zapewnia wystarczający oddech, gdy wysiłek oddechowy jest nieobecny i zapewnia stały lub zmienny końcowo-wydechowy PAP (EPAP) w celu utrzymania drożności górnych dróg oddechowych. Podejście to ma naśladować nosowy ciągły PAP (CPAP) pod względem pneumatycznego otwierania górnych dróg oddechowych i bezpośrednio tłumić centralne bezdechy senne bez powodowania nadmiernej wentylacji.1 W hipokapnicznym centralnym bezdechu sennym (CSA), w którym główną rolę odgrywa hiperwentylacja, wykazano, że ASV nieznacznie zwiększa stężenie dwutlenku węgla u pacjentów z niewydolnością serca (HF).1
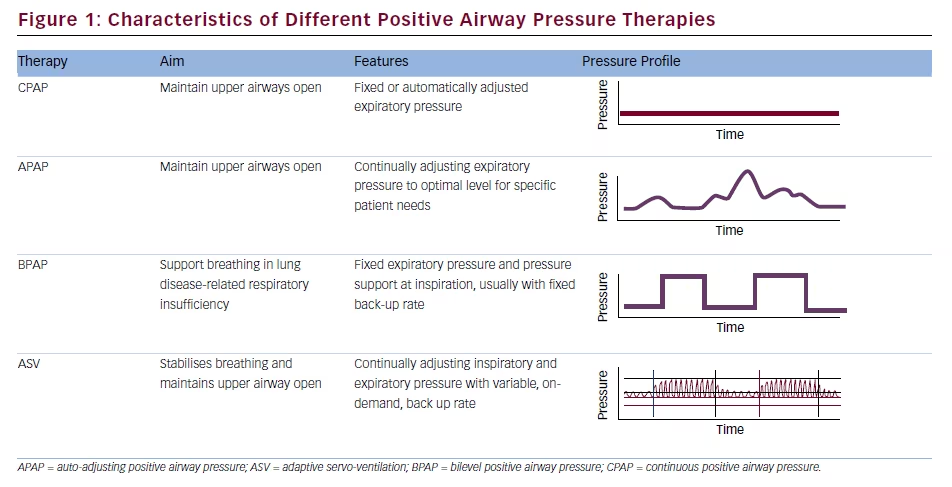
Profil ciśnienia zapewniany przez urządzenia ASV różni się od innych terapii PAP (patrz ryc. 1). Chociaż dostępne są ustawienia domyślne, bardziej odpowiednie jest indywidualne miareczkowanie dla każdego pacjenta w laboratorium snu,2 a najlepszym podejściem do utrzymania komfortu pacjenta, maksymalnego przestrzegania zaleceń i zachowania hemodynamiki jest stosowanie minimalnych skutecznych ustawień dla IPAP, EPAP i częstości rezerwowej.3
Najnowsze dane z badań dotyczących adaptacyjnej serwowentylacji
Na ogół dane dotyczące stosowania urządzeń ASV pochodziły z małych i/lub niekontrolowanych badań i głównie z klinik snu. Zmieniło się to ostatnio po opublikowaniu wyników badania SERVE-HF.4
SERVE-HF było pierwszym długoterminowym, randomizowanym, kontrolowanym, międzynarodowym, wieloośrodkowym badaniem IV fazy, którego celem było zbadanie wpływu dodania ASV do postępowania medycznego opartego na wytycznych w porównaniu z samym postępowaniem medycznym (kontrola) na przeżycie i wyniki sercowo-naczyniowe u pacjentów z objawową HF i obniżoną frakcją wyrzutową (EF) (HFrEF; EF ≤45%), u których dominował CSA. W badaniu SERVE-HF potwierdzono zdolność terapii ASV do istotnego zmniejszenia wskaźnika bezdechu-hipopnoe (AHI) oraz poprawy saturacji tlenem i innych parametrów zaburzonego oddychania podczas snu (SDB), ale efekty te nie przełożyły się na poprawę wyników klinicznych.4
Niespodziewanie wyniki badania były neutralne dla pierwszorzędowego punktu końcowego – pierwszego zdarzenia złożonego ze zgonu z dowolnej przyczyny, interwencji sercowo-naczyniowej ratującej życie (zdefiniowanej jako przeszczep serca,
implantacja urządzenia do długotrwałego wspomagania komór, resuscytacja po nagłym zatrzymaniu krążenia lub odpowiedni wstrząs w celu wywołania komorowych zaburzeń rytmu serca u pacjentów z wszczepionym kardiowerterem-defibrylatorem) lub nieplanowana hospitalizacja z powodu pogorszenia HF – ze współczynnikiem ryzyka (HR) wynoszącym 1.13 (95-procentowy przedział ufności 0,97, 1,32; p=0,113).4 Być może jeszcze bardziej zaskakujące było zidentyfikowanie sygnału bezpieczeństwa w grupie ASV, w której pacjenci leczeni za pomocą urządzenia byli bardziej narażeni na ryzyko zgonu z wszystkich przyczyn (HR 1,28, 95-procentowy przedział ufności 1,06, 1,55; p=0,01) i z przyczyn sercowo-naczyniowych (HR 1,34, 95-procentowy przedział ufności 1,09, 1,65; p=0,006).4 Nie stwierdzono istotnych różnic pomiędzy grupą ASV a grupą kontrolną w odniesieniu do objawów, zdolności wysiłkowych czy jakości życia. Wpływ ASV na gazy we krwi, EF lewej komory i biomarkery jest obecnie oceniany w głównym badaniu SERVE-HF (NCT01164592)5 , którego wyniki będą dostępne wkrótce. Dane te mogą pomóc w lepszym wyjaśnieniu głównych wyników badania SERVE-HF.
Chociaż wyniki badania SERVE-HF stanowią zmianę paradygmatu dla ASV, odnoszą się one jedynie do podgrupy pacjentów leczonych ASV (tj. pacjentów z HFrEF i dominującym CSA) i nie ma żadnych dowodów wskazujących na potrzebę całkowitego zaprzestania rozważania tej terapii. ASV była badana w innych wskazaniach, a gromadzące się dowody sugerują, że ASV może mieć znaczenie w wielu grupach pacjentów poza tymi z HFrEF.
Adaptacyjna serwowentylacja w niewydolności serca z zachowaną frakcją wyrzutową
Chociaż negatywny wpływ prognostyczny HF z zachowaną EF (HFpEF) jest podobny do HFrEF,6 te dwie postacie HF reprezentują różne zespoły kliniczne i dlatego powinny być badane i leczone oddzielnie.7 HFpEF występuje częściej u kobiet i częściej ma etiologię niesercową,6,8 a obecnie nie ma dostępnych metod leczenia opartych na dowodach naukowych.8 Ponadto istnieją istotne różnice między HFpEF i HFrEF w odniesieniu do nasilenia i zakresu dysfunkcji mięśnia sercowego, wzorców przebudowy komór serca i na poziomie ultrastrukturalnym oraz odpowiedzi na interwencje terapeutyczne.7 W związku z tymi różnicami można oczekiwać, że wyniki leczenia ASV u pacjentów z HFpEF będą inne niż w populacji badania SERVE-HF z HFrEF.
Wyniki dwóch niewielkich badań9,10 z okresem obserwacji wynoszącym odpowiednio 12 i 18 miesięcy sugerują, że korzystne działanie ASV u pacjentów z HFpEF może wykraczać poza poprawę wskaźnika AHI i parametrów snu. W jednym z badań porównano pacjentów z HFpEF z oddychaniem Cheyne’a-Stokesa (CSR), u których zastosowano ASV (n=39), z podobnymi pacjentami, którzy z różnych powodów odmówili ASV (n=21), w okresie obserwacji od 3 do 24 (średnio 11,6) miesięcy.9 Wyniki badania snu wykazały, że ASV istotnie zmniejszyła AHI, najdłuższe bezdechy i hipopnoe oraz maksymalną desaturację w porównaniu z grupą kontrolną. Ponadto, podczas prób wysiłkowych, u pacjentów z grupy ASV w porównaniu z grupą kontrolną, obserwowano istotny wzrost szczytowego poboru tlenu (wartość bezwzględna i procent przewidywanego), poboru tlenu na progu tlenowo-anaerobowym oraz pulsu tlenowego. Odnotowano również istotne zmniejszenie średnicy lewego przedsionka i szczytowej prędkości wczesnego napływu mitralnego metodą Dopplera (E)/szczytowej prędkości napływu mitralnego metodą Dopplera w przedsionku (A) oraz istotne zwiększenie A, średniej prędkości wczesnego wydłużenia rozkurczu (e') i E/e'.
W randomizowanym badaniu obejmującym 36 stabilnych pacjentów z HFpEF z centralną SDB porównano częstość występowania zdarzeń sercowych u pacjentów, którzy otrzymywali samo zoptymalizowane leczenie i zoptymalizowane leczenie medyczne plus ASV (średnia obserwacja 543 dni). Zdarzenie sercowe definiowano jako zgon sercowy lub ponowną hospitalizację z powodu dekompensacji HF. W ciągu 6 miesięcy leczenia pacjenci z HFpEF w grupie ASV mieli wyższy wskaźnik wolnych od zdarzeń (94,4%) niż pacjenci w grupie bez ASV (61,1%; p10 Udokumentowano również istotnie większą poprawę w stosunku do wartości wyjściowych w zakresie stężenia peptydu natriuretycznego typu B i klasy czynnościowej według Nowojorskiego Towarzystwa Kardiologicznego (New York Heart Association, NYHA) w grupie ASV w porównaniu z grupą bez ASV, ale nie stwierdzono istotnej zmiany w echokardiograficznie określonej EF lewej komory od wartości wyjściowej do 6 miesięcy. Z punktu widzenia SDB, redukcja AHI w stosunku do wartości wyjściowej wynosiła 30,2/h w grupie ASV w porównaniu z 8.2/h w grupie bez ASV (p10
Możliwe, że zwiększona częstość nagłych zgonów sercowych związana z leczeniem ASV w przypadku CSA u pacjentów z HFrEF zidentyfikowana w badaniu SERVEHF4 może być inna w HFpEF, gdzie podstawowe ryzyko nagłego zgonu sercowego jest niższe
. Jednak, aby definitywnie odpowiedzieć na to pytanie, konieczne są większe, długoterminowe badania z twardymi wynikami klinicznymi (np. śmiertelność). Dopóki takie dane nie będą dostępne, decyzję o stosowaniu ASV w leczeniu CSA u pacjentów z HFpEF należy podejmować indywidualnie, pod kierunkiem kardiologa (patrz poniżej zalecenia dotyczące monitorowania terapii ASV).
Adaptacyjna terapia serwo-wentylacyjna w bezdechu sennym
Centralny bezdech senny związany z leczeniem
Centralny bezdech senny związany z leczeniem, znany wcześniej jako złożony bezdech senny, występuje u około 5-15% pacjentów poddawanych miareczkowaniu PAP z powodu obturacyjnego bezdechu sennego (OSA). Definicja CSA związanego z leczeniem to utrzymywanie się lub pojawienie się centralnych bezdechów i hipnopnoezy podczas rozpoczynania terapii PAP bez podtrzymującej częstości oddechów w przypadku OSA, pomimo znacznego ustąpienia obturacyjnych zdarzeń oddechowych.11 U większości pacjentów CSA związany z leczeniem jest zjawiskiem przejściowym, które nie jest stabilne w czasie.12-14 Jednym z możliwych wyjaśnień jest to, że fragmentacja snu i przesunięcia faz snu związane z miareczkowaniem CPAP powodują niestabilność kontroli wentylacji. Sugestię tę potwierdza stwierdzenie, że CSA wywołane leczeniem występuje częściej w noce, w których pacjenci leczeni CPAP śpią źle.12 Innymi czynnikami predysponującymi mogą być: obecność choroby wieńcowej, wcześniejsze występowanie bezdechów centralnych, ciężkość OSA i stosowanie opioidów.12,14 Konieczne jest jednak leczenie podgrupy pacjentów z CSA wywołanym leczeniem, które utrzymuje się podczas ciągłego stosowania CPAP lub żółciowego PAP (biPAP) bez częstotliwości rezerwowej. W takich sytuacjach ASV jest najbardziej odpowiednią terapią.
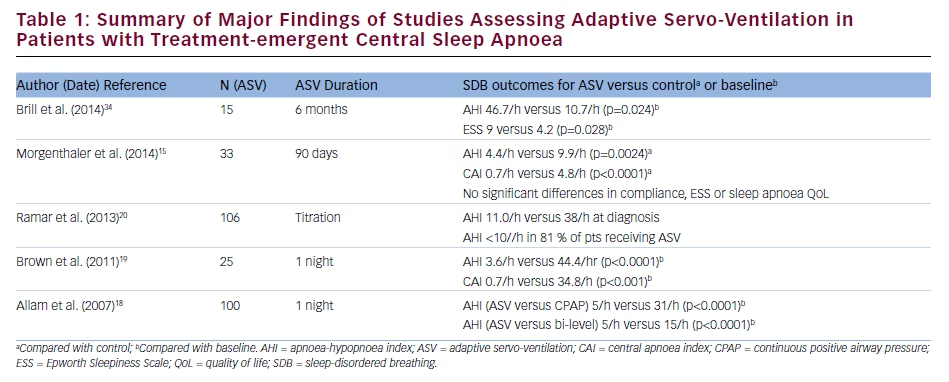
Wpływ ASV na wyniki kliniczne i wyniki badania polisomnograficznego (PSG) u pacjentów z CSA niezwiązanym z leczeniem porównano z wpływem CPAP w prospektywnym, randomizowanym badaniu klinicznym z udziałem 66 pacjentów.15 Po dwóch nocach miareczkowania AHI wynosił 5,7/h w grupie ASV w porównaniu z 14,1/h w grupie CPAP (p≤0,0003); odpowiednie wartości po 90 dniach leczenia wynosiły 4,4/h i 9,9/h (p=0,0024). CAI po miareczkowaniu wynosił 1,1/h w grupie ASV i 8,8/h w grupie CPAP (p≤0,0003), a po 90 dniach odpowiednio 0,7/h i 4,8/h (p16 Korzystny wpływ ASV w wieloośrodkowym, prospektywnym badaniu obserwacyjnym z udziałem 27 pacjentów z CSA lub CSA powikłanym leczeniem obejmował poprawę w zakresie AHI, CAI, wskaźnika obturacyjnego bezdechu i wskaźnika pobudzenia podczas miareczkowania terapii, które to zmiany utrzymywały się przez 3 miesiące leczenia17. Ponadto podczas stosowania ASV doszło do istotnego zmniejszenia wyniku w skali senności Epworth (ESS) (z 12,8 w punkcie wyjściowym do 7,8; p=0,001); średnie przestrzeganie ASV wynosiło 4,2 h/noc. Dane te są poparte wynikami retrospektywnych analiz, w których wykazano, że ASV jest skuteczniejsza niż inne terapie PAP pod względem redukcji wskaźnika AHI i poprawy jakości snu u pacjentów z CSA niezwiązanym z leczeniem.18-20 Podsumowanie wyników badań dotyczących stosowania ASV u pacjentów z CSA związanym z leczeniem przedstawiono w tabeli 1.
Opioidowe bezdechy Cheyne’a-Stokesa
Bezdechy centralne wykrywano za pomocą PSG u 17-24% pacjentów długotrwale leczonych opioidami z powodu przewlekłego bólu.21,22 W wielu badaniach klinicznych wykazano, że terapia ASV poprawia SDB u osób przyjmujących opioidy, a wynik metaanalizy wykazał, że leczenie ASV u pacjentów z CSA związanym z opioidami spowodowało u 58% pacjentów osiągnięcie CAI równego 23
Już po 1 nocy stosowania ASV u pacjentów otrzymujących długotrwałą terapię opioidami z powodu bólu nienowotworowego, u których występował CSA, w jednym prospektywnym badaniu wieloośrodkowym zaobserwowano istotne klinicznie zmniejszenie AHI, CAI i wskaźnika hipopnoezy; Poprawa ta utrzymywała się przez 3 miesiące terapii domowej ASV.24 Zarówno krótko-, jak i długoterminowe zmniejszenie AHI i CAI podczas terapii ASV udokumentowano również w innym badaniu dotyczącym CSA związanego z opioidami, a długoterminowe stosowanie się do terapii ASV w tym przypadku było dobre (średnio 5,1 h/noc w okresie obserwacji od 9 miesięcy do 6 lat).25 Odsetek pacjentów, u których uzyskano odpowiedź na leczenie również wydaje się być wysoki – 59,6% osiągnęło AHI równe 26. ASV może mieć również zdolność do poprawy obturacyjnych bezdechów w tym przypadku.27
Dane porównawcze wskazują, że ASV jest skuteczniejsza w redukcji bezdechów centralnych u osób przewlekle przyjmujących opioidy niż zarówno biPAP, jak i CPAP. W małej grupie osób przewlekle przyjmujących opioidy, u których nie uzyskano poprawy w zakresie bezdechu sennego podczas 1 nocy terapii CPAP, zastosowanie ASV przez 1 noc całkowicie wyeliminowało bezdechy centralne i obturacyjne oraz zmniejszyło wskaźnik hipopnoezy do 13/h, w porównaniu z AHI wynoszącym 70/h na początku i 55/h podczas stosowania CPAP.28 W innym badaniu wartości AHI i CAI były istotnie
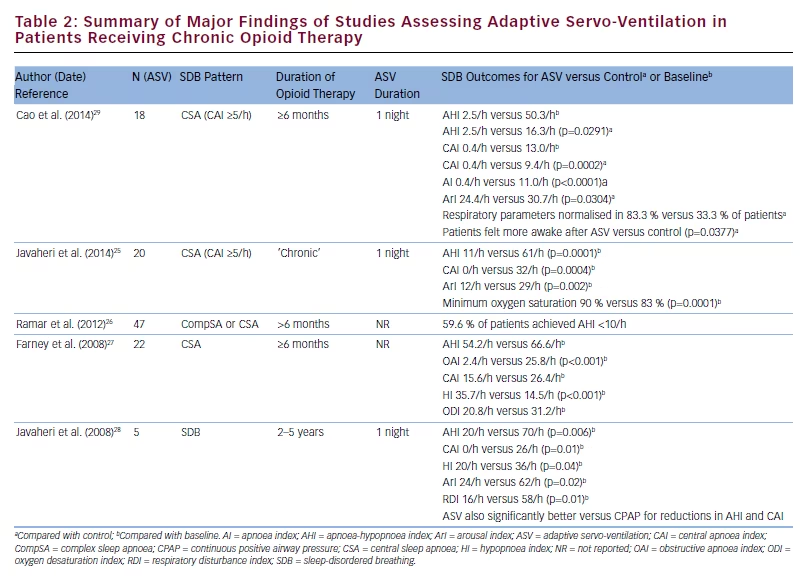
niższe podczas krótkotrwałego stosowania ASV w porównaniu z biPAP w trybie spontaniczno-timedycznym (biPAP-ST) (2,5/h vs. 16.3/h; p=0,0005 i 0,4/h vs 9,4/h; p=0,0002, odpowiednio).29 W tym prospektywnym, krzyżowym badaniu odsetek pacjentów, u których doszło do normalizacji parametrów oddechowych wynosił 83,3% podczas ASV i 33% podczas biPAP-ST.3% podczas stosowania bilevel-ST, a wyniki w kwestionariuszu zadowolenia pacjenta „Morning After Patient Satisfaction Questionnaire” wykazały, że pacjenci czuli się bardziej przytomni po zastosowaniu ASV w porównaniu z leczeniem bilevel-ST (p=0,0337).29 Wyniki badań dotyczących stosowania ASV u pacjentów z bezdechem sennym otrzymujących długotrwałe leczenie opioidami podsumowano w tabeli 2.
Idiopatyczny oddech Cheyne-Stokesa
W niektórych przypadkach, pomimo szeroko zakrojonych badań, nie udaje się znaleźć oczywistej przyczyny CSA-CSR i określa się to mianem idiopatycznego CSR, którego dokładna częstość występowania nie jest znana. Wykonalność zastosowania ASV w leczeniu idiopatycznego CSR oceniano u trzech pacjentów, którzy nie reagowali dobrze na CPAP i tlenoterapię. Leczenie ASV zmniejszyło wskaźnik nieprawidłowych zdarzeń z 35,2/h do 3,5/h, a także istotnie zmniejszyło liczbę przebudzeń (18,5/h do 1,1/h). Co ważne, obserwacja po 6-12 miesiącach wykazała istotną poprawę czujności w ciągu dnia i nastroju u osób przyjmujących ASV.30
Bezdech senny po udarze niedokrwiennym mózgu
SDB można udokumentować u 50% do 70% pacjentów po ostrym udarze niedokrwiennym mózgu31,32 i utrzymuje się on po ostrym okresie u znacznej części chorych.33 Rola ASV w leczeniu przetrwałego CSA po ostrym udarze niedokrwiennym mózgu była badana u 15 pacjentów, z których 13 było wcześniej nieskutecznie leczonych CPAP lub biPAP.34 AHI wynosił 46,7/h na początku i zmniejszył się do 8,5/h (p=0,001) i 10,7/h (p=0,024) odpowiednio po 3 i 6 miesiącach stosowania ASV. ASV poprawiła również senność w ciągu dnia, z obniżeniem wyniku w skali ESS z 8,6 na poziomie wyjściowym do 5,6 podczas stosowania ASV (p=0,08). U pacjentów, którzy stosowali ASV przez ≥5 h/noc, wynik ESS zmniejszył się z 9,0 na początku badania do 4,2 (p=0,028). Czas stosowania ASV podczas badania był dobry, średnio 5 godzin 20 minut na noc w ciągu 3 miesięcy i 6 godzin 22 minuty na noc w ciągu 6 miesięcy. ASV była również dobrze tolerowana i nie odnotowano żadnych poważnych działań niepożądanych.
Kiedy nie stosować adaptacyjnej serwowentylacji
Jak zawsze, ASV nie powinna być stosowana w sytuacjach, w których w stanie podstawowym występuje hipowentylacja. Dlatego przed rozpoczęciem leczenia należy sprawdzić stężenie gazów we krwi, tak jak w przypadku każdej innej strategii wentylacji. Ponadto, w oparciu o wyniki badania SERVE-HF, ASV jest obecnie przeciwwskazana u pacjentów z HFrEF (EF lewej komory 45% lub mniej) i dominującym CSA. Wszyscy pacjenci otrzymujący obecnie ASV, którzy spełniają te kryteria, powinni zostać poinformowani o wynikach badania SERVE-HF i ich implikacjach oraz przestawieni na alternatywny sposób leczenia.
Monitorowanie terapii
Nie ma obecnie opublikowanych wytycznych dotyczących monitorowania pacjentów i obserwacji podczas terapii ASV. Dlatego lekarze muszą kierować się doświadczeniem klinicznym i zdrowym rozsądkiem. Przed rozpoczęciem leczenia wydaje się celowe sprawdzenie, czy u pacjenta nie występują objawy HF, dokładne zapoznanie się z historią choroby (ze szczególnym uwzględnieniem zdarzeń sercowych) oraz, w razie wątpliwości, określenie EF lewej komory za pomocą badania echokardiograficznego (zwłaszcza u pacjentów, u których mogą występować choroby układu sercowo-naczyniowego). Krótkoterminowa obserwacja powinna obejmować kontrolę przecieków, działań niepożądanych i przestrzegania zaleceń terapeutycznych. Ocena skuteczności leczenia za pomocą poligrafii lub PSG po 1-3 miesiącach, a 6-miesięczna kontrola obejmująca wywiad kliniczny, pobranie danych z maszyny i pełną ocenę kliniczną wydaje się uzasadniona. Stałe monitorowanie echokardiograficzne EF wydaje się rozsądne w przypadku stosowania ASV u pacjentów z chorobą serca.
Perspektywy i przyszłe kierunki
Ważnym obszarem prowadzonych obecnie badań jest wyjaśnienie mechanizmów patofizjologicznych leżących u podstaw sygnału bezpieczeństwa sercowo-naczyniowego zidentyfikowanego u pacjentów z HFrEF leczonych ASV w badaniu SERVE-HF. Pozwoli to na identyfikację specyficznych podgrup pacjentów z HFrEF, u których należy unikać stosowania ASV oraz innych, u których terapia ASV może przynieść korzyści. Dane z głównego badania SERVE-HF5 i analizy w trakcie leczenia, badania ADVENT-HF (NCT01128816) oraz trwających rejestrów, takich jak francuskie wieloośrodkowe prospektywne badanie kohortowe FACE35 , pozwolą na uzyskanie pewnego wglądu w stosowanie ASV w podgrupach pacjentów z HFrEF z CSA, pacjentów z HFrEF i OSA lub OSA ze współistniejącym CSA oraz pacjentów z HFpEF i obiema postaciami SDB. Efekty ASV u pacjentów z ostrą zdekompensowaną HF są badane w badaniu CAT-HF (NCT01953874). Poza HF potrzeba więcej danych na temat stosowania ASV u pacjentów z różnymi fenotypami CSA, w tym z bezdechami centralnymi wywołanymi leczeniem i opioidami.
Wniosek
Pozostaje wiele pytań bez odpowiedzi dotyczących obecnego i przyszłego miejsca terapii ASV u pacjentów z różnymi postaciami SDB. Na podstawie wyników badania SERVE-HF należy unikać terapii ASV u pacjentów z HFrEF i dominującym CSA z CSR, a w przypadku stosowania ASV w innych wskazaniach zaleca się ścisłe monitorowanie pacjentów, zwłaszcza w podgrupach zagrożonych rozwojem HF. Dostępne obecnie dane wskazują jednak na korzystne działanie ASV u chorych z CSA nie wymagającym leczenia, bezdechami centralnymi związanymi z długotrwałą terapią opioidami bez hipowentylacji pęcherzykowej, idiopatycznym CSR, po udarze niedokrwiennym mózgu oraz u chorych z HFpEF. Długoterminowe dane dotyczące wpływu ASV na zachorowalność i śmiertelność w tych grupach chorych nie są jeszcze dostępne, dlatego rozpoczęcie leczenia jest decyzją, którą należy podjąć indywidualnie dla każdego pacjenta, a terapię kontynuować tylko wtedy, gdy chory wykaże subiektywną i obiektywną poprawę w trakcie leczenia.
ADVENT-HF = The Effect of Adaptive Servo-Ventilation on Survival and Hospital Admissions in Heart Failure
CAT-HF = Cardiovascular Improvements with MV ASV Therapy in Heart Failure
FACE = French Cohort Study of Chronic Heart Failure Patients with Central Sleep Apnoea Eligible for Adaptive Servo-Wentylacja
SERVE-HF = Treatment of Sleep-Disordered Breathing with Predominant Central Sleep Apnea by Adaptive Servo-Ventilation in Patients with Heart Failure