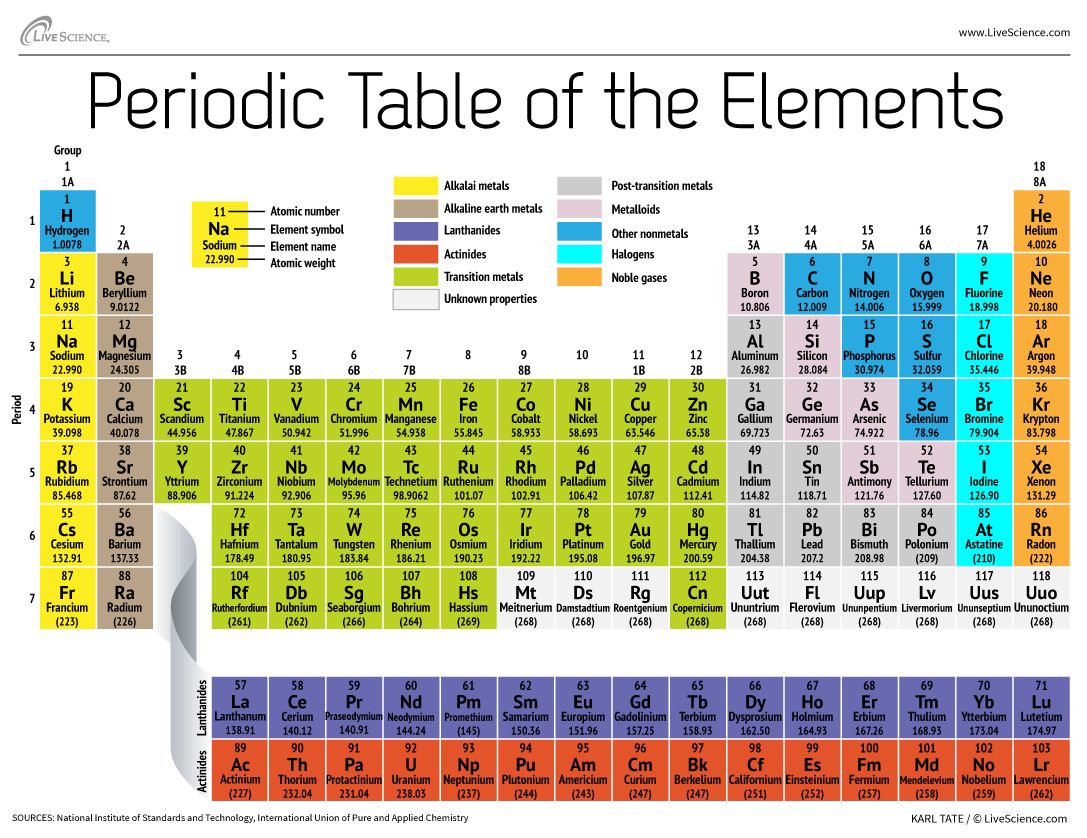
Układ okresowy pierwiastków porządkuje wszystkie znane pierwiastki chemiczne w przejrzystą tablicę. Pierwiastki są ułożone od lewej do prawej i od góry do dołu w kolejności rosnącej liczby atomowej. Kolejność zazwyczaj pokrywa się z rosnącą masą atomową.
Rzędy nazywane są okresami. Numer okresu dla danego pierwiastka oznacza najwyższy poziom energetyczny, jaki zajmuje elektron w tym pierwiastku (w stanie niewzbudzonym), zgodnie z Los Alamos National Laboratory. Liczba elektronów w okresie wzrasta wraz z przesuwaniem się w dół układu okresowego; dlatego też, wraz ze wzrostem poziomu energetycznego atomu, wzrasta liczba podpoziomów energetycznych na każdy poziom energetyczny.
Pierwiastki, które zajmują tę samą kolumnę w układzie okresowym (zwaną „grupą”) mają identyczne konfiguracje elektronów walencyjnych i w konsekwencji zachowują się w podobny sposób pod względem chemicznym. Na przykład, wszystkie pierwiastki grupy 18 są gazami obojętnymi.
„Ojciec” układu okresowego
Dymitr Mendelejew, rosyjski chemik i wynalazca, jest uważany za „ojca” układu okresowego, według Królewskiego Towarzystwa Chemicznego. W latach 60-tych XIX wieku Mendelejew był popularnym wykładowcą na uniwersytecie w Sankt Petersburgu w Rosji. Ponieważ w tamtym czasie nie było jeszcze nowoczesnych podręczników chemii organicznej w języku rosyjskim, Mendelejew postanowił napisać jeden z nich, a jednocześnie zająć się problemem pierwiastków nieuporządkowanych.
Układanie pierwiastków w jakimkolwiek porządku okazało się dość trudne. W tym czasie znano mniej niż połowę pierwiastków, a o niektórych z nich podawano błędne dane. To było jak praca nad naprawdę trudną układanką, w której jest tylko połowa elementów, a niektóre z nich są zniekształcone.
Mendelejew ostatecznie napisał ostateczny podręcznik chemii swoich czasów, zatytułowany „Zasady chemii” (dwa tomy, 1868-1870), według Khan Academy. Pracując nad nim, natknął się na znaczące odkrycie, które w znacznym stopniu przyczyniło się do powstania obecnego układu okresowego. Po zapisaniu właściwości pierwiastków na kartkach, zaczął je porządkować według rosnącej masy atomowej, jak podaje Royal Society of Chemistry. Wtedy właśnie zauważył, że pewne typy pierwiastków pojawiają się regularnie. Po trzech dniach intensywnej pracy nad tą „łamigłówką” Mendelejew powiedział, że miał sen, w którym wszystkie pierwiastki ułożyły się tak, jak trzeba. Po przebudzeniu natychmiast zapisał je na kartce papieru – tylko w jednym miejscu, jak później stwierdził, konieczna była korekta.
Mendelejew ułożył pierwiastki zarówno według masy atomowej, jak i walencyjności. Nie tylko zostawił miejsce dla pierwiastków jeszcze nie odkrytych, ale przewidział właściwości pięciu z nich i ich związków. W 1869 r. przedstawił wyniki badań Rosyjskiemu Towarzystwu Chemicznemu. Jego nowy układ okresowy został opublikowany w niemieckim czasopiśmie chemicznym Zeitschrift fϋr Chemie (Journal of Chemistry).
Czytanie tablicy
Układ okresowy zawiera ogromną ilość ważnych informacji:
Liczba atomowa: Liczba protonów w atomie określana jest jako liczba atomowa danego pierwiastka. Liczba protonów określa, jaki to jest pierwiastek, a także określa jego zachowanie chemiczne. Na przykład, atomy węgla mają sześć protonów, atomy wodoru jeden, a atomy tlenu osiem.
Symbol atomowy: Symbol atomowy (lub symbol pierwiastka) jest skrótem wybranym do reprezentowania pierwiastka („C” dla węgla, „H” dla wodoru i „O” dla tlenu, itd.). Symbole te są używane na całym świecie i czasami są nieoczekiwane. Na przykład, symbol wolframu jest „W”, ponieważ inna nazwa dla tego elementu jest wolfram. Również, symbol atomowy dla złota, jeśli „Au”, ponieważ słowo dla złota w języku łacińskim jest aurum.
Waga atomowa: Standardowa masa atomowa pierwiastka to średnia masa pierwiastka w jednostkach masy atomowej (amu). Poszczególne atomy mają zawsze całkowitą liczbę atomowych jednostek masy; jednakże masa atomowa w układzie okresowym jest podawana jako liczba dziesiętna, ponieważ jest to średnia różnych izotopów danego pierwiastka. Średnia liczba neutronów dla danego pierwiastka może być znaleziona poprzez odjęcie liczby protonów (liczby atomowej) od masy atomowej.
Waga atomowa dla pierwiastków 93-118: Dla naturalnie występujących pierwiastków, waga atomowa jest obliczana na podstawie uśrednienia wag naturalnych obfitości izotopów tego pierwiastka. Jednakże dla wytworzonych w laboratorium pierwiastków transuranowych – pierwiastków o liczbach atomowych wyższych niż 92 – nie istnieje „naturalna” liczebność. Konwencja polega na podawaniu masy atomowej najdłużej żyjącego izotopu w układzie okresowym. Te wagi atomowe powinny być uważane za tymczasowe, ponieważ w przyszłości może zostać wyprodukowany nowy izotop o dłuższym okresie połowicznego rozpadu.
W ramach tej kategorii znajdują się pierwiastki superciężkie, czyli te o liczbach atomowych powyżej 104. Im większe jądro atomu – które rośnie wraz z liczbą protonów w środku – tym bardziej niestabilny jest ten pierwiastek, ogólnie rzecz biorąc. Jak podaje Międzynarodowa Unia Chemii Czystej i Stosowanej (IUPAC), pierwiastki te są ulotne, trwają zaledwie milisekundy, zanim rozpadną się na lżejsze elementy. Na przykład, superciężkie pierwiastki 113, 115, 117 i 118 zostały zweryfikowane przez IUPAC w grudniu 2015 roku, uzupełniając siódmy rząd lub okres w tabeli. Kilka różnych laboratoriów wyprodukowało superciężkie pierwiastki. Liczby atomowe, nazwy tymczasowe i nazwy oficjalne to:
- 113: ununtrium (Uut), nihonium (Nh)
- 115: ununpentium (Uup), moscovium (Mc)
- 117: ununseptium (Uus), tennessine (Ts)
- 118: ununoctium (Uuo), oganesson (Og)
Dodatkowe raportowanie przez Traci Pedersen, Live Science contributor
Ostatnie wiadomości