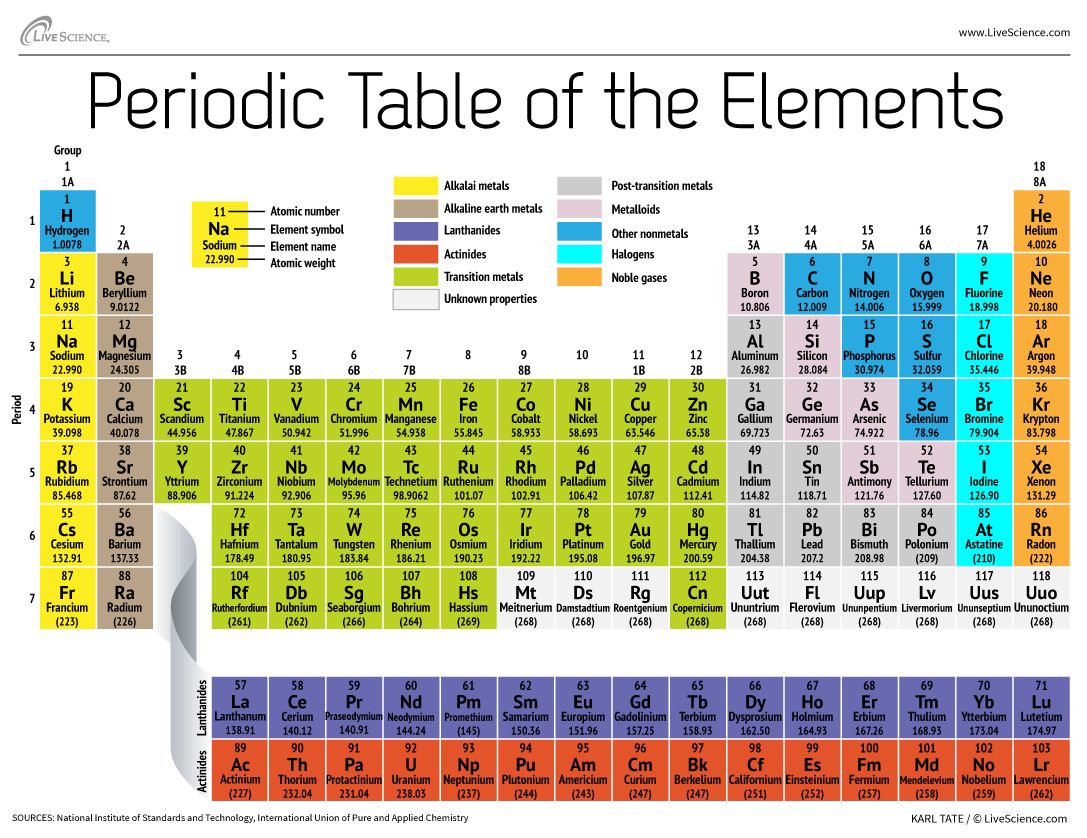
La tavola periodica degli elementi dispone tutti gli elementi chimici conosciuti in una serie informativa. Gli elementi sono disposti da sinistra a destra e dall’alto in basso in ordine di numero atomico crescente. L’ordine generalmente coincide con l’aumento della massa atomica.
Le righe sono chiamate periodi. Il numero del periodo di un elemento indica il livello di energia più alto che un elettrone in quell’elemento occupa (nello stato non eccitato), secondo il Los Alamos National Laboratory. Il numero di elettroni in un periodo aumenta man mano che si scende nella tavola periodica; quindi, man mano che il livello energetico dell’atomo aumenta, il numero di sottolivelli energetici per livello energetico aumenta.
Gli elementi che occupano la stessa colonna della tavola periodica (chiamati “gruppo”) hanno configurazioni di elettroni di valenza identiche e di conseguenza si comportano chimicamente in modo simile. Per esempio, tutti gli elementi del gruppo 18 sono gas inerti.
“Padre” della tavola periodica
Dmitri Mendeleev, un chimico e inventore russo, è considerato il “padre” della tavola periodica, secondo la Royal Society of Chemistry. Negli anni 1860, Mendeleev era un popolare docente in un’università di San Pietroburgo, in Russia. Dato che a quel tempo non c’erano libri di testo di chimica organica moderna in russo, Mendeleev decise di scriverne uno, e contemporaneamente affrontare il problema degli elementi disordinati.
Mettere gli elementi in qualsiasi tipo di ordine si sarebbe rivelato piuttosto difficile. All’epoca si conosceva meno della metà degli elementi, e ad alcuni di questi erano stati forniti dati errati. Era come lavorare su un puzzle molto difficile con solo la metà dei pezzi e con alcuni pezzi deformati.
Mendeleev alla fine scrisse il testo di chimica definitivo del suo tempo, intitolato “Principi di chimica” (due volumi, 1868-1870), secondo Khan Academy. Mentre ci stava lavorando, si imbatté in una scoperta significativa che avrebbe contribuito notevolmente allo sviluppo dell’attuale tavola periodica. Dopo aver scritto le proprietà degli elementi su dei cartoncini, cominciò a ordinarli per peso atomico crescente, secondo la Royal Society of Chemistry. Fu allora che notò che certi tipi di elementi apparivano regolarmente. Dopo aver lavorato intensamente su questo “puzzle” per tre giorni, Mendeleev disse di aver fatto un sogno in cui tutti gli elementi cadevano al loro posto come richiesto. Quando si svegliò, li scrisse immediatamente su un pezzo di carta – solo in un punto sembrò necessaria una correzione, disse più tardi.
Mendeleev dispose gli elementi secondo il peso atomico e la valenza. Non solo lasciò spazio agli elementi non ancora scoperti, ma predisse le proprietà di cinque di questi elementi e dei loro composti. Nel 1869, presentò i risultati alla Società Chimica Russa. Il suo nuovo sistema periodico fu pubblicato nel periodico tedesco di chimica Zeitschrift fϋr Chemie (Giornale di Chimica).
Leggere la tavola
La tavola periodica contiene un’enorme quantità di informazioni importanti:
Numero atomico: Il numero di protoni in un atomo è indicato come il numero atomico di quell’elemento. Il numero di protoni definisce che elemento è e determina anche il comportamento chimico dell’elemento. Per esempio, gli atomi di carbonio hanno sei protoni, gli atomi di idrogeno ne hanno uno e gli atomi di ossigeno ne hanno otto.
Simbolo atomico: Il simbolo atomico (o simbolo dell’elemento) è un’abbreviazione scelta per rappresentare un elemento (“C” per il carbonio, “H” per l’idrogeno e “O” per l’ossigeno, ecc.) Questi simboli sono usati a livello internazionale e a volte sono inaspettati. Per esempio, il simbolo del tungsteno è “W” perché un altro nome per questo elemento è wolframio. Inoltre, il simbolo atomico per l’oro è “Au” perché la parola per l’oro in latino è aurum.
Peso atomico: Il peso atomico standard di un elemento è la massa media dell’elemento in unità di massa atomica (amu). I singoli atomi hanno sempre un numero intero di unità di massa atomica; tuttavia, la massa atomica sulla tavola periodica è indicata come un numero decimale perché è una media dei vari isotopi di un elemento. Il numero medio di neutroni per un elemento può essere trovato sottraendo il numero di protoni (numero atomico) dalla massa atomica.
Peso atomico per gli elementi 93-118: Per gli elementi presenti in natura, il peso atomico è calcolato dalla media dei pesi delle abbondanze naturali degli isotopi di quell’elemento. Tuttavia, per gli elementi trans-uranio creati in laboratorio – elementi con numeri atomici superiori a 92 – non esiste un’abbondanza “naturale”. La convenzione è di elencare il peso atomico dell’isotopo più longevo nella tavola periodica. Questi pesi atomici dovrebbero essere considerati provvisori poiché un nuovo isotopo con un’emivita più lunga potrebbe essere prodotto in futuro.
In questa categoria ci sono gli elementi superpesanti, o quelli con numero atomico superiore a 104. Più grande è il nucleo dell’atomo – che aumenta con il numero di protoni al suo interno – più instabile è quell’elemento, generalmente. Come tali, questi elementi fuori misura sono fugaci, durano solo millisecondi prima di decadere in elementi più leggeri, secondo l’Unione internazionale di chimica pura e applicata (IUPAC). Per esempio, gli elementi superpesanti 113, 115, 117 e 118 sono stati verificati dalla IUPAC nel dicembre 2015, completando la settima riga, o periodo, della tabella. Diversi laboratori hanno prodotto gli elementi superpesanti. I numeri atomici, i nomi temporanei e i nomi ufficiali sono:
- 113: ununtrio (Uut), nihonium (Nh)
- 115: ununpentium (Uup), moscovium (Mc)
- 117: ununseptium (Uus), tennessine (Ts)
- 118: ununoctio (Uuo), oganesson (Og)
Integrazione di Traci Pedersen, Live Science contributor
Notizie recenti