Scoperto per la prima volta nel 1961 e fino agli anni ’70, l’amiodarone è stato utilizzato per le sue proprietà antiaritmiche, anche se non ufficialmente prima dell’anno 1985, quando gli Stati Uniti hanno finalmente approvato il suo uso. La Food and Drug Administration (FDA) era stata riluttante ad approvare il farmaco a causa dei rapporti iniziali che mostravano una maggiore incidenza di effetti polmonari avversi. Le aziende farmaceutiche europee iniziarono a discutere con l’istituzione a metà degli anni ’80 e minacciarono di sospendere la loro fornitura (gratuita) del farmaco ai medici americani, se la FDA non avesse concesso l’approvazione ufficiale. L’autorizzazione fu finalmente rilasciata nel dicembre 1985, rendendolo uno dei pochi farmaci approvati dalla FDA senza precedenti studi clinici randomizzati.
I – Meccanismo d’azione ed effetti farmacologici
I due atomi di iodio contenuti nella molecola di amiodarone, un derivato benzofurano, sono essenziali per le sue proprietà antiaritmiche. Usando la classificazione Vaughan-Williams dei farmaci antiaritmici, l’amiodarone prolunga il potenziale d’azione di fase 3 delle cellule cardiache e ha anche tutte le caratteristiche elettrofisiologiche di classe 4. L’assorbimento è estremamente lento e anche la biodisponibilità è bassa e variabile. La latenza tra la somministrazione e l’effetto, tuttavia, può essere ridotta utilizzando un alto carico di dose orale o endovenosa.
D’altra parte, il farmaco si lega completamente alle proteine plasmatiche e ha un grande volume di distribuzione. Viene poi metabolizzato nel fegato. La clearance è anche bassa con un’emivita di eliminazione stimata di 30-180 giorni a causa del suo metabolita, desetilamiodarone, che fa sì che il farmaco si accumuli nei tessuti periferici che agiscono come serbatoi a causa della loro affinità per i fosfolipidi intralisosomali. Questi corpi di inclusione sono stati trovati nei polmoni, fegato, cuore, pelle, epitelio corneale e nervi periferici, che spiegano i suoi effetti tossici in molti organi e la relazione proporzionale tra tossicità, durata di utilizzo e dose cumulativa.
Una dose standard di mantenimento giornaliero di 200 mg di amiodarone rilascia 75 mg di iodio organico. È importante sottolineare che il normale fabbisogno giornaliero di iodio è da 0,2 a 0,8 mg – più di 100 volte inferiore a quello che viene fornito con l’amiodarone.
L’amiodarone a basso dosaggio (100-300 mg al giorno) è efficace per un’ampia varietà di aritmie ventricolari e sopraventricolari, anche come parte di una strategia di controllo del ritmo per i pazienti con fibrillazione atriale, soprattutto quando sono presenti malattie cardiache strutturali. Dove altri farmaci non sono riusciti a controllare le aritmie, saranno necessarie alte dosi di amiodarone che producono un aumento dell’incidenza di gravi effetti collaterali avversi.
II – Impatto della terapia con amiodarone sulla sopravvivenza nel contesto clinico
Diversi effetti collaterali sono stati descritti nel tempo, specialmente nei casi di uso cronico. Si stima che la prevalenza di effetti avversi legati al trattamento con amiodarone sia del 15% il primo anno e del 50% nei casi di somministrazione prolungata. Inoltre, il 20% dei pazienti richiede l’interruzione della terapia a causa di effetti quali danni al fegato, problemi alla funzione tiroidea e stridore polmonare cronico, che sono stati descritti fino all’1% per anno di trattamento, con danni cumulativi tra il 5% e il 10%. Il danno polmonare è il più noto: si produce dopo una lunga esposizione all’amiodarone (2.3), ma ci sono state anche segnalazioni di tossicità acuta.
Ecco gli effetti collaterali più frequenti del farmaco:
a) Polmone
La tossicità polmonare indotta da amiodarone (APT) è uno degli effetti collaterali più gravi dell’uso. L’incidenza è di circa il 5% quando si usano dosi di 400 mg o più al giorno.
Interessante, l’indagine di follow-up della fibrillazione atriale dello studio di gestione del ritmo (AFFIRM) ha trovato una maggiore incidenza di tossicità polmonare nei pazienti con malattia polmonare preesistente. Tuttavia la mortalità per cause polmonari e la mortalità complessiva non erano più alte tra questi pazienti, rispetto a quelli senza malattia polmonare preesistente.
Il meccanismo d’azione di questa patologia può essere diretto dal rilascio di radicali liberi, o indiretto dall’ipersensibilità del paziente. I fattori di rischio associati a questo effetto avverso non sono stati ben identificati, ma possono essere legati a dosi cumulative, dosi giornaliere superiori a 400 mg, età avanzata e malattia polmonare sottostante.
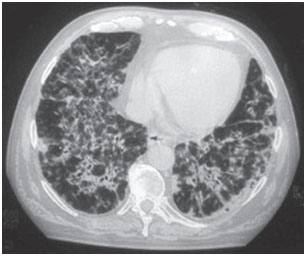
La tossicità polmonare da amiodarone può presentarsi in vari modi: polmonite interstiziale, distress respiratorio o masse polmonari solitarie. Gli scenari clinici sono variabili, i sintomi più comuni sono dispnea e tosse secca, ma i sintomi possono anche includere febbre, perdita di peso, emottisi e dolore toracico aggravato dai movimenti respiratori. Le radiografie del torace mostreranno cambiamenti di infiltrati interstiziali bilaterali irregolari o non uniformi (figure 1 e 2). I test di funzionalità respiratoria mostrano un modello restrittivo con capacità polmonare totale diminuita e diffusa. Il meccanismo della tossicità polmonare non è stato stabilito, ma sembra anche essere legato alla dose.
La diagnosi di APT è complicata dai suoi sintomi aspecifici, dai reperti clinici e dai risultati dei test di imaging e di laboratorio, quindi è considerata una diagnosi di esclusione. La diagnosi differenziale deve essere condotta con insufficienza cardiaca, polmonite, embolia polmonare e malattia neoplastica. La prognosi è favorevole, con un basso tasso di mortalità, ad eccezione dei pazienti che sviluppano distress respiratorio, la cui mortalità si avvicina al 50%. (3)
Il trattamento si basa sulla sospensione del farmaco e sulla somministrazione di corticosteroidi, che devono essere continuati per diversi mesi nonostante i casi di miglioramento iniziale dello stato del paziente, poiché la lunga emivita dell’amiodarone può provocare una nuova esacerbazione dei sintomi. La prevenzione e l’individuazione precoce di questa potenziale complicazione richiede una radiografia del torace ottenuta al basale e annualmente in seguito.
b) Tiroide
L’evidenza clinica di ipotiroidismo si verifica fino al 20% dei pazienti che assumono amiodarone. L’amiodarone impedisce la conversione periferica di T4 in T3 e altera i test di funzionalità tiroidea. Le grandi quantità di iodio contenute nell’amiodarone possono spiegare questi effetti.
Ipotiroidismo è facilmente gestito con levotiroxina e generalmente non è una causa per interrompere amiodarone. Ipertiroidismo si verifica nel 3% dei pazienti in aree carenti di iodio, ma nel 20% nelle aree in cui lo iodio è sufficiente. Può essere difficile da riconoscere perché molti dei segni tipici mediati dall’adrenalina sono bloccati dall’amiodarone.
Nei pazienti che assumono amiodarone, il primo mese di trattamento rivela un aumento di T4 (20%-40%), T3 inversa (20%) e TSH, e una diminuzione di T3, che tende a tornare alla normalità a tre mesi.
In alcuni casi, la ricorrenza della fibrillazione atriale in pazienti con terapia di mantenimento dell’amiodarone, ha richiesto una rapida valutazione per escludere l’ipertiroidismo indotto dall’amiodarone.
L’aumento del rischio si verifica nei pazienti con funzione tiroidea di base anormale (malattia autoimmune, gozzo) e negli anziani. Le donne con anticorpi antitiroidei positivi sono sette volte più a rischio di questa complicazione.
Raccomandiamo un’analisi di TSH, T4 e T3 all’inizio del trattamento, un mese dopo il trattamento e successivamente ogni sei mesi.
La diagnosi è presunta quando ci sono livelli aumentati di TSH e diminuiti di T4 e T3. Vogliamo ricordare ai nostri lettori che l’aumento del TSH durante i primi tre mesi dopo l’inizio del trattamento con amiodarone non è un problema di per sé perché può essere un fenomeno transitorio – il trattamento con amiodarone può essere continuato a condizione di aggiungere levotiroxina. Anche la triiodotironina può essere aggiunta a volte se i valori del TSH non sono diminuiti adeguatamente. La gestione richiederà allora l’assistenza di un endocrinologo esperto e la sospensione della terapia con amiodarone.
In tutti i pazienti, i livelli di tireotropina dovrebbero essere controllati prima di iniziare la terapia con amiodarone e successivamente ogni mese.
c) Altre aree – gastrointestinali, epatiche, cardiache, oftalmiche, cutanee
I disturbi gastrointestinali come nausea, vomito, diarrea o anoressia sono frequenti (30%) al basale. Tuttavia, alcuni dei più temuti effetti collaterali gastrointestinali – epatite e cirrosi epatica – sono rari (<3%). Si raccomanda di testare la funzionalità epatica all’inizio del trattamento, e poi ogni sei mesi. All’inizio del trattamento, si osserva generalmente un aumento degli enzimi epatici; la sospensione del trattamento non è raccomandata a meno che i loro valori non superino due o tre volte la norma. Questo aumento, secondo alcuni autori, non è indicativo della necessità di interrompere il farmaco: tuttavia, si raccomanda uno stretto monitoraggio.
Effetti avversi cardiaci tra cui bradicardia sono stati riportati nel 5% dei pazienti, e aritmie ventricolari polimorfe (torsade de pointes) nell’1%-2% dei pazienti, soprattutto tra quei soggetti con fattori di rischio per essa. Pertanto, un ECG dovrebbe essere eseguito al basale e poi annualmente. Nei pazienti con un defibrillatore cardioverter (ICD), l’amiodarone può aumentare la lunghezza del ciclo delle tachicardie ventricolari, il che può farle rilevare e può interferire con l’efficacia del dispositivo (4).
Infine, tra gli altri effetti avversi minori, quasi il 100% dei pazienti che ricevono questo farmaco per più di sei mesi presentano microdepositi di cornea. La loro presenza non richiede l’interruzione del trattamento, dato che non sono legati a un deterioramento dell’acuità visiva. Reazioni oculari, come neurite ottica, atrofia con perdita della vista o entrambe, sono più gravi, ma sono rare e non c’è una causalità provata dell’amiodarone rispetto a queste. La valutazione oftalmologica è indicata solo se c’è un deficit visivo.
Altri effetti collaterali riportati includono fotosensibilità e pigmentazione blu della pelle, che scompaiono dopo la sospensione del trattamento. Nel nostro paziente, dopo aver completato vari test e aver sospettato che il quadro clinico del paziente corrispondesse al TPA, l’amiodarone è stato interrotto ed è stata iniziata una terapia con corticosteroidi (40-60 mg al giorno per sei mesi). Con questo trattamento, il paziente ha avuto un recupero clinico e radiologico soddisfacente.
Infine, l’amiodarone può causare ipotensione in circa il 15% dei pazienti che lo ricevono per via endovenosa. L’ipotensione può essere trattata inizialmente diminuendo la velocità di infusione.
Figura 1A. Radiografie posteroanteriori del torace fatte al momento della presentazione clinica e dopo tre mesi di trattamento. L’amiodarone infiltra i campi polmonari basali bilaterali alveolointerstiziali; tuttavia, i mezzi sono scomparsi al follow-up (immagine più sotto).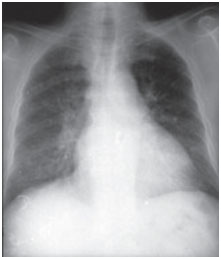
Figura 1B. Tomografia computerizzata del torace- nello stesso paziente, campione infiltrato alveolointerstiziale bilaterale e diffuso con aree di broncogramma aereo.