INTRODUZIONE ALLE ANIDRIDI ACIDE
Questa pagina spiega cosa sono le anidridi acide e guarda le loro semplici proprietà fisiche come i punti di ebollizione. Introduce la loro reattività chimica in modo generale, ma i dettagli delle reazioni specifiche sono dati in pagine separate – vedi il menu anidridi acide (link in fondo alla pagina).
Cosa sono le anidridi acide?
La struttura delle anidridi acide
Un acido carbossilico come l’acido etanoico ha la struttura:
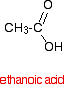
Se si prendono due molecole di acido etanoico e si toglie una molecola di acqua tra di esse si ottiene l’anidride acida, l’anidride etanoica (vecchio nome: anidride acetica).
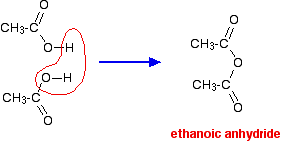
Si può effettivamente fare l’anidride etanoica disidratando l’acido etanoico, ma normalmente viene fatta in un modo più efficiente e indiretto. (Fare l’anidride etanoica va oltre lo scopo del livello A del Regno Unito.)
Nominare le anidridi acide
Questo è molto facile. Basta prendere il nome dell’acido padre e sostituire la parola “acido” con “anidride”. “Anidride” significa semplicemente “senza acqua”.
Quindi… l’acido etanoico forma l’anidride etanoica; l’acido propanoico forma l’anidride propanoica, e così via.
Per gli scopi del livello A nel Regno Unito, l’unico che probabilmente incontrerete è l’anidride etanoica.
Proprietà fisiche delle anidridi acide
Prendiamo l’anidride etanoica come tipica.
Apparenza
L’anidride etanoica è un liquido incolore, con un forte odore di aceto (acido etanoico).
L’odore è dovuto al fatto che l’anidride etanoica reagisce con il vapore acqueo nell’aria (e l’umidità nel tuo naso) per produrre nuovamente acido etanoico. Questa reazione con l’acqua è data in dettaglio in un’altra pagina. (Trovala dal menu anidridi acide – link in fondo a questa pagina.)
Solubilità in acqua
Non si può dire che l’anidride etanoica si dissolva in acqua perché reagisce con essa per dare acido etanoico. Non esiste una soluzione acquosa di anidride etanoica.
Punto di ebollizione
L’anidride etanoica bolle a 140°C. Questo perché è una molecola polare abbastanza grande e quindi ha sia forze di dispersione di van der Waals che attrazioni dipolo-dipolo.
Non forma però legami idrogeno. Ciò significa che il suo punto di ebollizione non è così alto come quello di un acido carbossilico di dimensioni simili. Per esempio, l’acido pentanoico (l’acido di dimensioni più simili) bolle a 186°C.