WPROWADZENIE
Wirusy są patogenami, które stanowią szczególny problem u biorców przeszczepów, ponieważ kwestia zakażeń wirusowych w transplantacjach odzwierciedla złożoną równowagę między różnymi infekcjami wirusowymi, które pacjent może mieć w ciągu całego życia, antywirusową odpowiedzią immunologiczną biorcy i poziomem immunosupresji wymaganym do zapewnienia sprawnego przeszczepu.
Zakażenie poliomawirusem BK (BKV) stanowi coraz większy problem w przeszczepach nerek i jest uważane za cenę nowoczesnej i silnej immunosupresji (IS).
BIOLOGICZNE ASPEKTY WIRUSA
Poliomawirusy, wraz z brodawczakami, należą do rodziny patogenów brodawczakowatych. Wirus BK (BKV) należy do rodziny poliomawirusów wraz z innymi poliomawirusami, które zostały wykryte u ludzi, takimi jak wirus JC (JCV), wirus KI, wirus WU, wirus raka komórek Merkla i wirus Simian 40 (SV40).
Wirusy te są małymi, nierozwiniętymi wirusami o średnicy 42 nm. Kapsyd ma symetrię ikosaedryczną i zawiera podwójnie kolisty łańcuchowy genom DNA o długości ponad 5000 par zasad, składający się z regionu „wczesnego”, który jest wysoce konserwowany i koduje antygen T/t (TAg), który jest zaangażowany w transformację, replikację wirusową oraz regulację i ekspresję genów; oraz region „późny”, który koduje trzy białka kapsydu, znane jako VP1, VP2 i VP3, oraz białko zwane „agnoproteiną”, niekodujący region regulacyjny położony pomiędzy dwoma pozostałymi, gdzie znajdują się determinanty replikacji, związek TAg i elementy regulacji transkrypcji.
Poliomawirus posiada specyficzność adaptacyjną do swojego gospodarza, dlatego jego ewolucja jest prawdopodobnie związana z ewolucją gatunku gospodarza, a więc naturalne zakażenie występuje tylko u ograniczonej liczby blisko spokrewnionych gatunków, stanowiąc marker do ustalenia różnic rasowych między ludźmi.
Używając analizy sekwencjonowania genów, ustalono różne genotypy: europejski, azjatycki i afrykański. Pozostałe genotypy odpowiadają rekombinacjom tych trzech, i chociaż jego pochodzenie jest trudne do ustalenia, badania nad tym wirusem mogą stanowić narzędzie pomocne w zrozumieniu ewolucji ludzkich migracji.
BKV jest związany z dwoma powikłaniami obserwowanymi u biorców przeszczepów: Nefropatią związaną z wirusem BK (BKVN) w przeszczepach nerek oraz krwotocznym zapaleniem pęcherza moczowego w przeszczepach szpiku kostnego. W przeciwieństwie do wirusa BKV, JCV, choć bytuje w nabłonku moczowym i zwykle ulega reaktywacji, rzadko wywołuje nefropatię, ale wiąże się z wieloogniskową leukoencefalopatią i zapaleniem mózgu. SV40, pochodzący od małp, został wprowadzony do populacji ludzkiej poprzez szczepionki zanieczyszczone polio i adenowirusem, i chociaż jego obecność została wykryta w biopsjach przeszczepionych nerek, jego znaczenie w transplantacji nerek nie jest jeszcze dobrze zdefiniowane.
EPIDEMIOLOGIA I CZYNNIKI RYZYKA
Pierwotne zakażenie występuje subklinicznie w pierwszej dekadzie życia, a seroprewalencja w populacji dorosłych wynosi ponad 80%.
Źródłem zakażenia jest wyłącznie człowiek, nie wykazano, aby zwierzęta pełniły rolę rezerwuaru, a droga transmisji może być fekalno-oralna, oddechowa, przezłożyskowa i przez oddane tkanki. W fazie wiremii wirus zakaża tkanki, moczowody, tkankę limfatyczną i mózg, wywołując utajone zakażenie lityczne.
Po naturalnej transmisji wirusa w okresie niemowlęcym, BKV pozostaje w drogach moczowych z okresowymi reaktywacjami i niskim poziomem wiremii (Vr), 5%-10% u dorosłych o prawidłowej odporności.1,2 U osób z upośledzoną odpornością częstość BK Vr wzrasta do 20%-60%, częste są także jeszcze większe poziomy wiremii i pojawienie się komórek wabików w moczu.3
W przeszczepach nerek częstość występowania nefropatii związanych z wirusem BK (BKVN) oscyluje między 1% a 10%,4 co wynika bardziej z leczenia immunosupresyjnego i metod diagnostycznych niż z rzeczywistych różnic epidemiologicznych.
W 2004 roku leczenie zakażenia wirusem BKV po przeszczepieniu nerki włączono do amerykańskiej bazy danych jako zmienną dotyczącą ewolucji po przeszczepieniu (TBKV); dane przeanalizowano później, uzyskując łączną liczbę >48 000 przeszczepów, z których 1474 leczono w ciągu 24 miesięcy. Skumulowana częstość występowania TBKV zwiększała się wraz z upływem czasu, przechodząc z 3,45% w ciągu 24 miesięcy do 6,6% w 60 miesięcy po przeszczepieniu.
Niewydolność przeszczepu wtórna do BKVN występuje z częstością 50%-100% w ciągu 24 miesięcy w ośrodkach, w których nie ma programów przesiewowych, co podkreśla znaczenie wczesnego rozpoznania choroby.5
Zidentyfikowano różne protokoły IS jako czynniki ryzyka rozwoju BKVN, zwłaszcza stosowanie potrójnej terapii lekami przeciwklinicznymi, mykofenolanem mofetylu (MMF) i steroidami,5,6 ale opisywano również przypadki BKVN przy stosowaniu innych schematów IS, co wskazuje, że czynnikiem ryzyka w tym przypadku jest intensywność leczenia IS, a nie sam lek. Istnieją również inne rodzaje czynników ryzyka, takie jak czynniki związane z pacjentem (mężczyźni > 50 lat, biorca BKV seronegatywny), czynniki związane z przeszczepem (dawca BKV seropozytywny, niezgodność HLA, uraz immunologiczny lub niedokrwienny) oraz czynniki wirusowe (utajona wiremia, serotyp kapsydu i zdolność do replikacji).7
BKVN DIAGNOZA HISTOLOGICZNA I PROGRESJA
Komórki Decoya, wiremia i wiremia wskazują jedynie na replikację wirusa, a nie na nefropatię, ale są kluczowymi narzędziami w zapobieganiu i monitorowaniu choroby.
Jedynym objawem klinicznym BKVN jest pogorszenie funkcji nerek, a kiedy to nastąpi, jest już za późno na interwencję, ponieważ uszkodzenie nerek zostało już wytworzone.
Rozpoznanie choroby można postawić jedynie na podstawie biopsji przeszczepu, w której stwierdza się typowe bazofilne jądrowe wtręty wirusowe w komórkach nabłonka (kanaliki, torebka Bowmana i/lub urotelium) oraz objawy zapalenia z tubulitis (ryc. 1A), podobne do tych, które występują w ostrym odrzucaniu przeszczepu przez limfocyty T. Dopiero immunohistochemiczne badanie BKVN pozwala na wykrycie zmian w komórkach nabłonka nerki. Dopiero zastosowanie techniki immunohistochemicznej dla SV-40 LTAg pozwala zaobserwować dodatnie barwienie jądrowe i zidentyfikować poliomawirusa (BK, JC) jako odpowiedzialnego za zapalenie, odrzucając w ten sposób diagnozę ostrego odrzucania przeszczepu przez limfocyty T (Rycina 1B) i potwierdzając diagnozę BKVN.
Zmiany histologiczne BKVN są ogniskowe i heterogenne, dlatego negatywna biopsja nie może wykluczyć diagnozy. W związku z tym badanie to należy powtórzyć, jeśli wiremia we krwi pacjenta utrzymuje się na wysokim poziomie.
Schematy histologiczne BKVN2,8,9 opierają się na identyfikacji i rozszerzeniu nacieku zapalnego oraz zwłóknienia związanego z infekcją wirusową, co pozwala na ustalenie trzech schematów histologicznych (ryc. 2).
Ewolucja kliniczna i możliwości wczesnego zapobiegania i diagnozowania
Powszechna ewolucja kliniczna BKVN9 jest przedstawiona na rycinie 3, która pokazuje, w jaki sposób rozwój choroby jest przewidywany przez pojawienie się wiremii BK (BK Vr), będącej konsekwencją reaktywacji i replikacji wirusa w drogach moczowych, z pojawieniem się typowych komórek wabików (ryc. 4), które są łatwe do zidentyfikowania przy użyciu rutynowych badań cytologicznych moczu. Jednak ilościowe oznaczanie Vr techniką PCR jest bardziej czułe niż cytologia i pozwala na rozróżnienie zakażeń BKV i JCV.
Gdy wiremia wynosi >105 kopii/ml i utrzymuje się, po tygodniach lub miesiącach następuje rozwój wiremii (Vm) przy >107 kopii/ml i w końcu BKVN. BK Vr nie jest diagnostyczne dla uszkodzenia miąższu nerki, ale jednoczesne pojawienie się Vm i Vr jest patognomoniczne dla uszkodzenia miąższu nerki (BKVN). Utrzymujące się lub, co bardziej typowe, narastające Vm jest czynnikiem predykcyjnym pogarszającej się funkcji nerek i koreluje z obecnością i nasileniem zmian histologicznych. U pacjentów z prawidłową lub umiarkowanie niską czynnością nerek prawdopodobieństwo znalezienia histologicznych wskaźników BKVN jest wprost proporcjonalne do czasu trwania i nasilenia wiremii. Podwyższona i utrzymująca się wiremia identyfikuje tych pacjentów z niekontrolowaną replikacją wirusa, która prowadzi do uszkodzenia nerek.
Wniosek: wczesne rozpoznanie i interwencja minimalizują uszkodzenie przeszczepu. Na rycinie 5 przedstawiono algorytm diagnostyczny oparty na wcześniejszych publikacjach.4,9
LECZENIE BKVN
Najlepszym sposobem leczenia BKVN jest wczesne rozpoznanie choroby w celu podjęcia działań zanim dojdzie do uszkodzenia nerek.
Z tego powodu wytyczne KDIGO10 sugerują stosowanie procesu przesiewowego u wszystkich pacjentów po przeszczepieniu nerki, polegającego na comiesięcznym oznaczaniu stężenia Vm w ciągu pierwszych 3 miesięcy (2D) i co 3 miesiące do końca pierwszego roku (2D), w każdym przypadku wystąpienia zaburzeń czynności nerek bez widocznej alternatywnej przyczyny (2D) oraz po leczeniu epizodu ostrego odrzucania (2D). Redukcję IS sugeruje się również, gdy Vm jest stale większe niż 107 kopii/ml (2D).
Jeśli chodzi o redukcję IS, pierwszym krokiem jest wdrożenie standardowego protokołu (niepodawanie CAN lub leczenia antyproliferacyjnego powyżej poziomów wskazanych dla zakresu terapeutycznego), a następnie pomiar wiremii co 4 tygodnie, zmniejszenie NAb o 15%-20%, zmniejszenie MMF i/lub supresji MMF o 50% i/lub zastąpienie TAC przez CsA lub ISP (ryc. 6).11
W odniesieniu do leczenia przeciwwirusowego empirycznie stosowano i.v. immunoglobuliny, cyklofowir, leflunomid i chinolony, a ich skuteczność jest obecnie trudna do określenia, ponieważ nie były one podawane w połączeniu z redukcją IS oraz z powodu braku kontrolowanych i randomizowanych badań prospektywnych.
Na koniec chcielibyśmy skomentować retransplantację nerki u pacjentów, którzy utracili przeszczep z powodu BKVN. Częstość nawrotów choroby w krótkich badaniach wynosi 12%. Zalecenia, które należy wziąć pod uwagę w takich sytuacjach to: 1) poinformowanie pacjenta o zwiększonym potencjalnym ryzyku nawrotu BKVN; 2) potwierdzenie braku replikacji wirusa (PCR z krwi i moczu w momencie wpisania pacjenta na listę transplantacyjną, a następnie co 6 miesięcy), pacjent musi otrzymać przeszczep przy ujemnym wyniku PCR z próbek krwi oraz 3) dostosowanie IS do patologii.12-14
KEY POINTS
1. Silne i nowoczesne formy immunosupresji mogą być odpowiedzialne za coraz częstsze występowanie tego zakażenia
2. Zakażenie wirusem BK u pacjentów z obniżoną odpornością może wpływać na funkcję i przeżywalność przeszczepów nerek
3. Wczesne rozpoznanie poprzez ścisłe monitorowanie liczby komórek zlewnych w moczu i/lub wiremii i wiremii jest kluczowe dla uniknięcia negatywnych skutków tego powikłania
4. Nie ma dowodów na istnienie swoistego skutecznego leczenia tego zakażenia. Jedynie ograniczenie leczenia immunosupresyjnego może zminimalizować wirulencję.
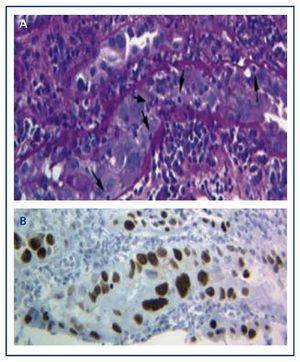
Rysunek 1. Bazofilne jądrowe wtręty wirusowe w komórkach nabłonka i tubulitis w nefropatii wywołanej wirusem BK (a) oraz immunohistochemia dla antygenu SV-40 LTAg (b)

Rysunek 2. Wzorce histologiczne nefropatii związanej z wirusem BK
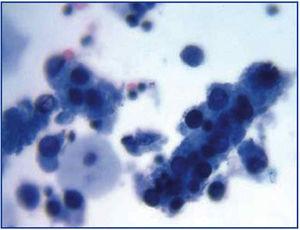
Figura 3. Rozproszone komórki przyzwojowe i cylindry komórkowe zawierające zbite komórki przyzwojowe. Cylindry te, gdy się pojawiają, są patognomiczne dla uszkodzenia nerek
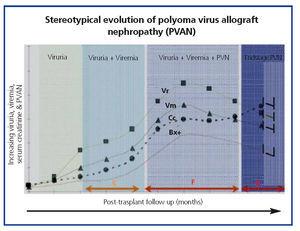
Rysunek 4. Fazy ewolucji nefropatii związanej z wirusem BK
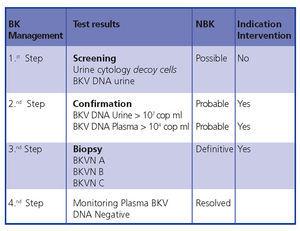
Figura 5. Algorytm diagnostyczny BKVN

Figura 6. Algorytm leczenia BKVN